
La terapia dell’ipotiroidismo si basa sulla somministrazione per os di levotiroxina, in monoterapia, nelle diverse formulazioni presenti in commercio (compresse, capsule gel e forme liquide), sulla base del presupposto di essere convertita a livello periferico nella sua forma attiva ossia in T3 (triiodotironina).
Tuttavia, alcune evidenze, sembrano documentare l’incapacità della terapia con la sola T4 di garantire ottimali livelli ormonali a livello tissutale e periferico. |
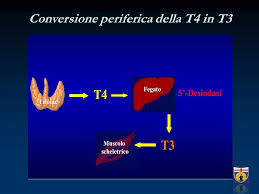 |
Ne deriva che il solo TSH risulta parzialmente adeguato e, a volte, insufficiente come marcatore “universale” del compenso tissutale.
Pertanto, sono emersi diversi studi che hanno cercato di individuare altri marcatori di compenso tiroideo periferico “complementari” al TSH.
In alcuni soggetti può infatti verificarsi un deficit di ormoni tiroidei a livello tissutale.
Nei ratti è stato dimostrato che sono necessari dosi sovra fisiologiche di T4 per ottenere normali concentrazioni tissutali di T3 nel polmone e nel tessuto grasso bruno.
Anche nell’uomo è dimostrato che spesso bisogna tenere la T4 ai limiti alti della norma per ottenere un buon compenso tissutale. Ciò nonostante, può accadere che il 15% dei soggetti trattati con T4 possa avere valori di FT3 inferiori al limite di normalità.
Non è infrequente nella pratica clinica, l’imbattersi in pazienti che, nonostante la normalizzazione del TSH, lamentano sintomi tipici di ipotiroidismo e una qualità della vita non ottimale e richiedono di essere trattati con dosi elevate di LT4 con rischio di effetti avversi.
Tale evenienza è più frequente nei soggetti tiroidectomizzati in cui l’assenza della quota di T3 prodotta direttamente dalla tiroide, li porta nel 15% dei casi, ad essere cronicamente in una condizione di bassa T3 pur mantenendo concentrazioni normali di TSH.
Ciò potrebbe dipendere anche dall’insufficiente conversione periferica in uno o più organi e tessuti della T4 in T3.
In tali soggetti si evidenzia “il limite” del solo TSH sierico quale “unico” marker di concentrazione degli ormoni tiroidei tissutali in molti organi e tessuti periferici.
Da ciò la necessità di individuare altri markers tissutali di funzionalità tiroidea di cui, di seguito, si passeranno in rassegna i più studiati.
 |
Uno dei marker epatici più sensibili alla variazione degli ormoni tiroidei è la SHBG (sex hormone binding globulin), una glicoproteina epatica che lega gli ormoni sessuali in circolo regolandone la biodisponibilità e la clearance metabolica.
La T3 stimola infatti la sintesi e la secrezione epatica di SHBG mediata indirettamente dal fattore nucleare 4-alfa epatocitario e da modifiche della lipogenesi sempre epatocitaria.
Ne deriva che la SHBG risulta diminuita nell’ipotiroidismo ed aumentata nell’ipertiroidismo.
Gli ormoni tiroidei stimolano anche la sintesi e il trasporto del colesterolo e la conversione in acidi biliari nel fegato. |
Ne deriva che nell’ipotiroidismo risultano aumentati il colesterolo totale, HDL e VLDL.
Sempre nell’ipotiroidismo possono riscontrarsi aumentati anche i livelli di trigliceridi e lipoproteina a.
Nell’ipertiroidismo, di contro, i valori di colesterolo totale ed HDL possono risultare ridotti mentre i trigliceridi e il VLDL colesterolo risultano normali.
Il meccanismo responsabile della riduzione del colesterolo operato dagli ormoni tiroidei è l’induzione dei recettori delle lipoproteine (LDL-R) che favoriscono l’assorbimento e l’internalizzazione delle LDL nelle cellule.
Nei tiroidectomizzati, spesso, è necessario somministrare dosi sub-soppressive di T4, per normalizzare il quadro lipidico e, comunque, per renderlo sovrapponibile a quello precedente alla tiroidectomia totale.
Altro marker di compenso tissutale tiroideo è la ferritina.
Nell’ipertiroidismo la ferritina risulta aumentata e nell’ipotiroidismo diminuita.
Tra i markers muscolari di compenso metabolico tissutale tiroideo vanno mensionati la CPK (creatinafosfochinasi) e la mioglobina che risultano entrambe aumentate nell’ipotiroidismo e normali nell’ipertiroidismo.
È stato segnalato che nei soggetti trattati con LT4 la normalizzazione della CPK e mioglobina precede quella del TSH.
 |
Tutto ciò è spiegabile dall’influenza degli ormoni tiroidei sulla contrattilità muscolare cardiaca e scheletrica agendo sulla trascrizione dei geni codificanti per le diverse isoforme di miosina, per la Na/K ATPasi e la Ca ATPasi sarcoplasmatica.
È noto che la T3 stimola gli osteoblasti in modo diretto e indiretto attraverso altre vie di segnali intracellulari. Nell’ipertiroidismo, ne consegue, si ha un elevato turnover osseo con prevalenza dei fenomeni riassorbitivi e rischio di osteoporosi e fratture.
Nell’ipotiroidismo, di contro si verifica una diminuzione dell’attività osteoclastica e osteoblastica con aumento della massa ossea. |
I markers della coagulazione ed enzimatici sono invece rappresentati dal D-DIMERO, dall’alfa2-antiplasmina e dal PAI (inibitore dell’attivatore del plasminogeno).
Nell’ipotiroidismo vi può essere una maggiore tendenza al sanguinamento e alle emorragie con riscontro di valori aumentati di Dimero D e ridotti livelli di PAI e alfa2-antiplasmina. |
 |
Nell’ipertiroidismo vi è invece una riduzione del Dimero D e un aumento dell’alfa2-antiplasmina e del PAI con maggior rischio trombotico.
 |
Un altro marker che correla in modo diretto con gli ormoni tiroidei è l’ACE (angiotensin converting enzyme) che risulta diminuito nell’ipotiroidismo e aumentato nell’ipertiroidismo.
Infine, sono da menzionare anche i markers genetici.
È noto che gli ormoni tiroidei hanno un’azione a livello nucleare regolando la trascrizione di alcuni geni target. Nell’ipotiroidismo vi sarebbe un up-regulation dei geni coinvolti nell’emostasi e dei trascritti muscolo specifici. |
In conclusione, premesso che il TSH rimane ad oggi il target di monitoraggio in tutte le linee guida internazionali, la presente disamina deve tuttavia farci riflettere nel prendere in considerazione, in alcuni pazienti non adeguatamente compensati con la sola T4, ad indagare il compenso tissutale periferico tiroideo con i markers prima elencati e, se del caso, associare piccole dosi di T3 in quantità il più possibile fisiologiche, specie nei soggetti atireosici con sintomatologia soggettiva indicativa di inadeguatezza della monoterapia con LT4.
RIFERIMENTI BIBLIOGRAFICI:
- Escobar-Morreale et al.: Replacement therapy for hypothyroidism with thyroxin alone does non ensure euthyrioidism in all tissues, as studied in thyroidectomized rats. J.Clin. Invest 96(6):2828-2838 (1995)
- Gullo D, Frasca F etc al.: Levothyroxine monoterapy cannot guarantee euthyroidism in all athyreotic patients. Plos one 6(8): e22552(2011)
- Hoermann R., Midgley JE et al: Recent advance in thyroid hormone regulation: toward a new paradigm for optimal diagnosis and treatment. Front Endocrinol 8:364 (2017)
- Hoermann R,Migdley JE et al: Is pituitary TSH an adeguate measure of thyroid hormone controlled homeostasis during thyroxine treatment? Eur J Endocrinol 168(2):271-280 (2013)
- Selva DM, Hammond GL: Thyroid hormones act indirectly to increase sex hormone binding globulin production by liver via hepatocyte nucklear factor 4 alfa. J Mol Endocrinol 43(1):19-27 (2009)
- Ness GC: Thyroid hormone. Basis for its hypocholesterolemic effect. J Fla Med Assoc 78(6):383-385
- Duntas LH: Thyroid disease and lipids. Thyroid 12(4):287-293
- Ito M et al: Biochemical markers reflecting thyroid function in athyreotic patients on levothyroxine monotherapy. Thyroid 27(4):484-490 (2017)
- Klein I et al: Resolution of abnormal muscle enzyme studies in ipothyroidism. Am J Med Sci 279(3):159-162
- Gogakos et al: Thyroid hormones in skeletal development and bone maintenance. Endocrin Rev 37(2):135-187(2016)
- Erem C: Coagulation and fibrinolysis in thyroid dysfunction Endocrine 36(1):110-118
- Lee DS et al Changes of serum angiotensin converting enzyme activity during treatment of patients with Grave’s disease. Korean J Intern Meds 1(1):104-112
- Castagna MG, Maino F, Cipri C, et al: Delayed Risk Stratification, to include the response to initial treatment (surgery and radioiodine ablation), has better outcome predictivity in differentiated thyroid cancer patients. Eur J Endocrinol 165:441-6, 2011.
|