Quasi tutti gli studi effettuati sugli ormoni tiroidei sono stati fatti sempre e solo sulla T3 e sulla T4 dando poca o nulla importanza ai prodotti del loro metabolismo periferico.
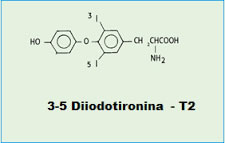 |
Oggi è invece risaputo che, oltre alla T3 e alla T4, altre iodotironine, da sempre considerate solo molecole innocue ed inattive prodotte dal metabolismo periferico della T3, possono controllare il metabolismo di riposo.
Mi riferisco alle diiodotironine ed in particolare alla T2. |
La T2, infatti, attivando rapidamente processi che portano all’ossidazione dei substrati a livello mitocondriale e che rendono inefficiente la fosforilazione ossidativa, incrementa il metabolismo di riposo (Resting Metabolic Rate) dell’animale in “toto”. Inoltre, la T2, quando somministrata cronicamente e simultaneamente ad una dieta iperlipidica,sembra prevenire l’insorgenza di: obesità, steatosi epatica, ipertrigliceridemia, ipercolesterolemia. Tali effetti, non essendo associati a fenomeni di tireotossicità renderebbero possibile l’utilizzo della T2 come “farmaco anti-obesità” e nella cura di patologie derivanti da un accumulo ectopico di grassi. Studi attualmente in atto sono rivolti ad individuare i meccanismi molecolari mediante i quali la T2 dirige la partizione lipidica verso l’ossidazione.
Nonostante molti degli effetti diretti mitocondriali degli ormoni tiroidei restino oscuri e controversi, è possibile che i loro effetti nucleari e non nucleari siano temporalmente coordinati e sinergici, e che essi possano essere mediati, oltre che dalla T3, anche dalle altre iodotironine.
Circa 25 anni fa è stato dimostrato che in una frazione mitocondriale arricchita di membrane interne isolate dal fegato, vi erano siti di legame per la T3.
Tali siti, come dimostrato da Goglia nel 1981, mostravano elevata affinità anche per la 3,3’-diiodotironina.
Quasi dieci anni dopo fu evidenziato da Horst e coll., che la T2, come la T3, a concentrazione pari a 1pM, provoca una rapida stimolazione (pochi minuti) del consumo di ossigeno in fegato perfuso ottenuto da ratti ipotiroidei.
Inoltre l’effetto della T3, ma non quello della T2, era abolito dalla presenza di un inibitore dell’attività della deiodinasi di tipo 1 suggerendo che gli effetti della T3 fossero il risultato della conversione a T2.
Successivamente furono condotti molti studi per comprendere gli effetti della T2 sul metabolismo energetico, sulla respirazione cellulare e su quella mitocondriale.
Negli studi di Lanni e altri, la somministrazione di una singola dose di T2 ha un effetto più rapido sulla respirazione mitocondriale rispetto alla T3, in quanto l’effetto della T2 è evidente già dopo un’ora, mentre quello della 35 T3 si manifesta dopo 24 ore.
Inoltre, l’effetto della T2 è indipendente dalla sintesi proteica in quanto è evidente anche in presenza di cicloesimide (O’Reilly e Murphy, 1992).
Ciò ha fatto presupporre a Moreno che gli effetti della T2 fossero mediati da una interazione diretta con i mitocondri mentre quelli della T3 fossero il risultato della sua azione a livello nucleare.
L’effetto della T2 sulla velocità del consumo di ossigeno mitocondriale ha suggerito che la stessa iodotironina potesse avere un effetto sul metabolismo energetico dell’intero animale.
Tale ipotesi fu confermata nel 1997 da risultati ottenuti da Lanni e coll.
Tali autori iniettarono una singola dose di diiodotironina a ratti ipotiroidei che presentavano l’attività degli enzimi deiodinasi bloccata ed esaminarono i cambiamenti nella velocità del metabolismo di riposo (RMR). In effetti l’RMR degli animali ipotiroidei che, era significativamente ridotto rispetto a quello degli animali eutiroidei, rispondeva in maniera differente in seguito alla somministrazione di T3 o T2 (entrambe alla dose di 25 µg/100g pc).
La T3, infatti, induceva un incremento nel RMR di quasi il 35% che iniziava 25-30 ore dopo la somministrazione della iodotironine, raggiungeva un massimo valore a 50-75 ore e si prolungava fino a 5-6 giorni dopo la somministrazione.
L’iniezione della T2 alla stessa dose, induceva una risposta diversa con incremento dell’RMR (di quasi il 40%) che iniziava tra 6 e 12 ore dopo la somministrazione, raggiungendo un picco a 24-30 ore e terminando quasi dopo 48 ore.
Inoltre se le iodotironine venivano somministrate simultaneamente all’actinomicina D, la stimolazione dell’RMR da parte di T3 era quasi completamente abolita, mentre quella indotta dalla T2 non causava alcuna attenuazione della stimolazione rilevata (Lanni e coll. 1996; Moreno e coll.1997).
MITOCONDRI
Tali dati depongono per l’ipotesi di un meccanismo di azione della T2 indipendente dal nucleo e che la rapida capacità eccito metabolica della T2 è indipendente dalla trascrizione.
Sono stati misurati gli effetti sull’RMR di una singola iniezione di T2 o T3 in animali resi ipotiroidei in seguito al trattamento con PTU e IOPA.
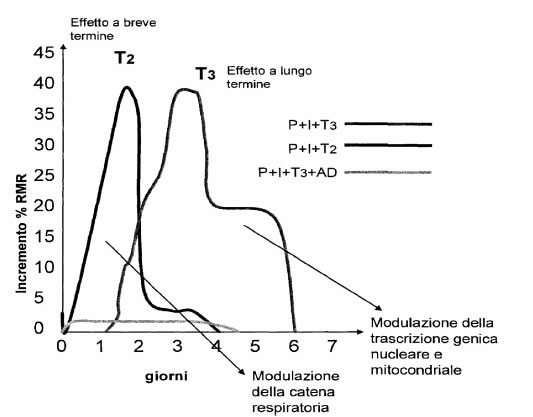
In queste condizioni la T2 e la T3 incrementano l’RMR sebbene i loro effetti differiscano in termini di time corse e di dipendenza dalla sintesi proteica.
La T3 agisce tramite un pathway mediato dal nucleo:il suo massimo effetto si rileva dopo 2-3 giorni e il suo effetto viene completamente bloccato dalla simultanea somministrazione di actinomicina D.
Al contrario, la 3,5-T2 stimola l’RMR in modo rapido: il suo massimo effetto si rileva già dopo 1 giorno ed è insensibile all’actinomicina D.
Situazioni in cui è richiesta una rapida produzione di calore quale ad esempio l’esposizione al freddo.

TERMOGENESI
In effetti sia T3 sia T2 migliorano la tolleranza al freddo ma attraverso differenti meccanismi.
In ratti ipotiroidei esposti ad una temperatura di 4°C sia la T3 che la T2 (somministrate cronicamente) aumentano la spesa energetica dell’animale e stimolano l’attività della citocromo ossidasi (COX) di tessuti metabolicamente molto attivi come il cuore, il muscolo scheletrico, il fegato e il BAT.
Un importante esperimento sull’effetto metabolico esercitato in vivo dalla T2 fu condotto da Cimmino e coll. (1996) che monitorarono la spesa energetica giornaliera, attraverso la misura del consumo di ossigeno e la produzione di biossido di carbonio, dell’animale in toto.
Tali autori evidenziarono che la somministrazione di T3 o di T2 a ratti ipotiroidei ripristinava il valore della spesa energetica caratteristica degli animali.
Lo stesso studio indicava che la T2 è in grado di stimolare significativamente la ß-ossidazione lipidica. Nonostante gli effetti in vivo della T2 su animali ipotiroidei siano chiari e riproducibili, la somministrazione della stessa, a ratti eutiroidei, non provoca alcun cambiamento nell’RMR.
Più fenomeni potrebbero essere alla base del mancato effetto della 3,5-T2 negli animali eutiroidei:
- La T2 viene rapidamentemetabolizzata
- La diiodotironina non entra adeguatamente nelle cellule
- Per raggiungere i bersagli cellulari la diiodotironina ha bisogno di essere formata da un precursore come la T3
- Lo stato metabolico degli animali (composizione della dieta) può avere un ruolo nel permettere agli effetti metabolici di T2 di essere rilevati
In particolare il punto c è stato chiarito dagli studi di Moreno e coll. (2002).
Tali autori hanno esaminato il cambiamento nell’RMR dopo somministrazione di T3 a ratti eutiroidei (N) ed hanno comparato i risultati con quelli ottenuti dopo iniezione acuta della stessa iodotironina in ratti resi ipotiroidei, che presentavano le deiodinasi bloccate (P+I), e in ratti eutiroidei che presentavano una inibizione delle deiodinasi.
I risultati hanno mostrato che
- l’iniezione acuta della T3 a ratti eutiroidei ha un evidente effetto sull’RMR che precede di circa 25 h 38 l’effetto osservato nei ratti P+I.
- la simultanea somministrazione di actinomicina D inibiva completamente l’ultima parte dell’effetto indotto da T3 sull’RMR di animali eutiroidei ma non ne aboliva l’effetto precoce
- la somministrazione di T3 e di actinomicina D ad animali ipotiroidei con le deiodinasi bloccate (P+I) confermava la completa perdita dell’effetto della T3 già osservato in precedenza dagli stessi autori (Moreno e coll. 2002)
- in ratti normali l’inibizione acuta delle deiodinasi (4 ore prima della somministrazione della T3) risultava in una riduzione nella parte precoce dell’effetto della T3 (che era anche indipendente dall’actinomicina D), indicando che la deiodinazione della T3 era una tappa metabolica necessaria per produrre il suo effetto
- il massimo incremento nell’RMR che, risultava essere actinomicina D insensibile, coincideva con il massimo della concentrazione epatica di T2, fenomeno che si verificava circa 25 h dopo l’iniezione di T3 a ratti eutiroidei (N)
Questi risultati indicavano che la parte iniziale dell’incremento dell’RMR che si verificava dopo somministrazione di T3 in ratti N era dovuto alla sua conversione in T2 il cui effetto è noto essere indipendente dall’actinomicina D; che la T3 è il precursore, in vivo, della T2 e che le deiodinasi sono coinvolte in tale processo.
Questa ultima evidenza è di notevole importanza in quanto in vitro non è stata mai messa in evidenza la genesi di 3,5-T2 a partire dalla T3.
BERSAGLI CELLULARI DELLA T2
L’idea dell’esistenza di una proteina citoplasmatica di legame (CTBP) che potesse mediare l’effetto della diiodotironina fu avanzata in seguito alla scoperta, attraverso marcatura per fotoaffinità, di siti di legame per la T2 nel citosol di cellule di fegato di ratto.
Furono identificate tre proteine: una di 86, una di 66 e la terza di 38 KDa (Moreno e coll. 2003); quest’ultima mostrava una maggiore affinità per la T2, legandola in assenza di NADPH; mentre la stessa proteina era anche in grado di legare la T3 ma solo in presenza di NADPH.
Siti specifici di legame per la T2 sono stati anche evidenziati nei mitocondri di fegato di ratto.
Essi mostrano un’alta affinità (dell’ordine di 108 M? 1) ed una bassa capacità di legame (0.4-0.6 pmoli/mg proteine) (Goglia e coll. 1994).
Le analisi di competizione hanno mostrato che i suddetti siti sono altamente specifici per la T2 e che altre iodotironine, quali 3,3’-T2, T3 e T4, sono in grado di competere significativamente soltanto quando sono presenti ad un’elevata concentrazione.
Per ottenere delucidazioni sulla natura biochimica di questi siti mitocondriali, Lombardi e coll. (1998) hanno effettuato studi nei quali l’analisi top-down dell’elasticità era applicata ai mitocondri isolati da ratti in cui era iniettata la diiodotironina in maniera acuta.
I risultati hanno mostrato che, 1h dopo la sua somministrazione, la T2 ha effetto sulle cinetiche di reazioni coinvolte nell’ossidazione dei substrati.
La diiodotironina agisce su due blocchi di reazioni della catena respiratoria: il complesso IV (COX) e il blocco delle reazioni coinvolte nella riduzione del citocromo C (Lombardi e coll. 1998).
La scoperta che l’aggiunta di T2 al complesso della COX isolato dai mitocondri di cuore bovino stimolava la sua attività indica che il complesso della COX può essere uno dei bersagli della T2 (Goglia e coll. 1994).
Arnold e coll. (1998) usando procedure di marcatura per fotoaffinità, identificarono la subunità Va del complesso della COX come sito di legame per la T2.
La natura specifica del legame è stata confermata utilizzando un anticorpo monoclonale contro la subunità Va, in presenza del quale veniva impedito il legame della diiodotironina alla subunità stessa (Arnold e coll., 1998).
Altre azioni indirettamente coinvolgenti i mitocondri potrebbero costituire parte dell’effetto biologico della T2.
Infatti, Hummerich e coll. (1989) suggerirono un’influenza della diiodotironina sull’attività mitocondriale che potrebbe essere mediata da un incremento nella captazione di calcio che si traduce in un’incrementata attività dei mitocondri dovuta all’aumento dell’attività delle deidrogenasi mitocondriali; questo dovrebbe portare a un incremento nella quantità di substrati ridotti disponibili per la catena respiratoria (Denton, McCormac, 1985).
Le deiodinasi mitocondriali possono generare la T3 ma anche la T2.
Il mitocondrio contiene specifici siti di legame per la T2, come la subunità Va del complesso COX, attraverso cui la diiodotironina modula l’attività della catena respiratoria.
La T2 viene formata all’interno della cellula ma può anche provenire dal plasma; tuttavia, specifici trasportatori per la T2 sulla membrana plasmatica non sono stati identificati.
Gli effetti della T2 sul mitocondrio dipendono dal legame della T2 con le CTBP e sono indipendenti dallo stato redox della cellula.
È stato evidenziato che la T2 è in grado di agire su alcuni importanti enzimi bersaglio dell’ormone tiroideo come quelli lipogenici (enzima malico e glucosio-6-fosfato-deidrogenasi).
La T2 è 3-5 volte più potente della T3 a stimolare l’attività della G6PD (il suo effetto non è né influenzato da inibitori della sintesi proteica, né induce cambiamenti nell’espressione dell’mRNA di G6PD) (Lombardi e coll. 2000).
IMPORTANZA DELLA T2 NEL RIDURRE L’ADIPOSITÀ NEI RATTI
 |
L’obesità, che è definita come aumento della massa del tessuto adiposo, comporta un più alto rischio di incorrere in malattie cardiovascolari e metaboliche come diabete, steatosi epatica, dislipidemia e malattie coronariche.
Fino ad ora ci sono stati pochi trattamenti per curare l’obesità e le sue relative complicazioni.
Gli ormoni tiroidei causano riduzione di peso attraverso un’incrementata velocità metabolica e una riduzione delle LDL tramite sia un upregulation dei recettori delle LDL che un incremento nel metabolismo del colesterolo. |
Nonostante ciò, la concomitante induzione dello stato tireotossico (incremento della massa della tiroide e del cuore, tachicardia, fibrillazione atriale, riduzione della massa muscolare) ha limitato l’utilizzo degli ormoni tiroidei e/o dei loro agonisti come agenti con attività anti-obesità.
I tentativi per eliminare gli effetti collaterali (soprattutto quelli cardiovascolari) mediante la somministrazione di Beta bloccanti adrenerdici non prevenivano l’eccessivo decremento nella massa corporea magra.
L’utilizzo di analoghi (essendo privi di effetti tirotossici) dovrebbe rappresentare un progresso terapeutico potenzialmente valido.
La T2 può indurre “dissipazione” metabolica, stimolando la perdita di energia mediante meccanismi che coinvolgono l’apparato mitocondriale piuttosto che i recettori nucleari per la T3.
Una tale azione potrebbe portare alla riduzione dell’adiposità e del peso corporeo senza indurre una sindrome clinica relazionata allo stato tireotossico.
Recenti ricerche suggeriscono che la somministrazione della T2 a ratti che ricevono una dieta iperlipidica (HFD) è in grado di ridurre l’adiposità e il peso corporeo senza indurre cambiamenti nei livelli serici di T3 e T4.
I ratti che ricevono T2 (HFD+ T2), quando paragonati ai ratti che ricevono solo una dieta iperlipidica, consumavano circa il 6% di cibo in più e mostravano un peso corporeo più basso del 13% (i loro pesi corporei non erano diversi da quelli dei ratti normali nutriti con una dieta standard).
Inoltre, i ratti HFD+ T2 avevano circa il 50% di massa grassa in meno, mentre la loro massa magra non era variata, e mostravano una completa scomparsa della steatosi epatica caratteristicamente indotta dalla dieta iperlipidica.
L’effetto anti-steatosico della T2 sui fegati di ratti HFD era accompagnato da un incremento (42%) del tasso di ossidazione degli acidi grassi e da una riduzione dei livelli serici di trigliceridi e colesterolo (-52% e -18%, rispettivamente).
Tale incremento nell’ossidazione degli acidi grassi coinvolge la regolazione dei principali componenti della via del malonil-CoA quali
- Acetil-CoA-carbossilasi (ACC) che è l’enzima limitante nella sintesi di malonil-CoA,
- Il citrato citosolico (un attivatore allosterico di ACC e il precursore del suo substrato, l’acetil-CoA citosolico)
- La proteina chinasi attivata dall’AMP (AMPK), un enzima attivato dalla riduzione nello stato energetico della cellula riflesso dall’aumento del rapporto AMP/ATP.
In effetti quando l’AMPK è nella sua forma attiva ossia fosforilata (PAMPK) fosforila e inattiva ACC, riducendo la concentrazione cellulare del malonil-CoA, un inibitore allosterico di CPT1 (enzima esterno del sistema della carnitina palmitoil transferasi) che è limitante per il trasporto degli acidi grassi nella matrice mitocondriale (e perciò per l’ossidazione degli acidi grassi).
Ridotti livelli di malonil-CoA portano all’attivazione di CPT1 e quindi ad un aumento nel trasporto degli acidi grassi nella matrice.
È stato verificato il coinvolgimento di questo pathway negli effetti della T2 sulla ß-ossidazione del fegato (misurando l’attività di CPT e ACC come pure la fosforilazione di AMPK nel fegato di ratto).
In effetti i dati hanno dimostrato che la T2 è in grado di incrementare la ß-ossidazione e l’uptake di acidi grassi attivati nei mitocondri (attraverso l’attivazione del sistema CPT) senza alcuna inibizione dell’attività di ACC ma con una forte attivazione di AMPK.
Ciò ha suggerito che la T2 potrebbe incrementare il flusso di acidi grassi nei mitocondri regolando CPT1 con una modalità dipendente da PAMPK ma allo stesso tempo indipendente da ACC-malonil-CoA.
La T2, stimolando l’ossidazione degli acidi grassi, può indurre una utilizzazione meno efficiente dei substrati lipidici stimolando un meccanismo termogenico come il disaccoppiamento mitocondriale (proton leak). Infatti, la proton leak (portando a una ridotta sintesi di ATP e ad un aumento nel consumo dei grassi) risultava maggiore nei ratti HFD+ T2 rispetto a quella dei ratti HFD (Lanni e coll. 2005). Questo suggerisce che la perdita protonica gioca un ruolo determinante negli effetti esercitati dalla 3,5- T2 sull’efficienza dell’utilizzazione dei substrati e quindi sull’adiposità.
BIBLIOGRAFIA
J Biol Regul Homeost Agents. 2011 Oct-Dec;25(4):655-60. 3,5-diiodo-L-thyronine increases resting metabolic rate and reduces body weight without undesirable side effects. Antonelli A1, Fallahi P, Ferrari SM, Di Domenicantonio A, Moreno M, Lanni A, Goglia F.
Endocrinology 2002 Feb;143(2):504-10. Are the effects of T3 on resting metabolic rate in euthyroid rats entirely caused by T3 itself? Moreno M1, Lombardi A, Beneduce L, Silvestri E, Pinna G, Goglia F, Lanni A.
How the thyroid controls metabolism in the rat: different roles for triiodothyronine and diiodothyronines. Moreno M, Lanni A, Lombardi A, Goglia F.J Physiol. 1997 Dec 1; 505 ( Pt 2):529-38.
Action of Thyroid Hormones, T3 and T2, on Hepatic Fatty Acids: Differences in Metabolic Effects and Molecular Mechanisms. Damiano F, Rochira A, Gnoni A, Siculella L.Int J Mol Sci. 2017 Mar 31; 18(4). Epub 2017 Mar 31.
3,5-Diiodo-L-thyronine activates brown adipose tissue thermogenesis in hypothyroid rats. Lombardi A, Senese R, De Matteis R, Busiello RA, Cioffi F, Goglia F, Lanni A.PLoS One. 2015; 10(2):e0116498. Epub 2015 Feb 6.
TESI DI DOTTORATO DI RICERCA IN BIOLOGIA APPLICATA IVXX “Effetti della 3,5 diiodo-L-tironina sul metabolismo lipidico del muscolo gastrocnemio di ratto” L.Napoli 2011.
TESI DI DOTTORATO DI RICERCA IN BIOLOGIA APPLICATA XXIII CICLO “La 3,5 diiodo-l-tironina, obesità e steatosi epatica: focus sulla funzionalità mitocondriale” G.Gifuni 2011
- top -
|